搜索


近日,国际核酸研究领域顶级期刊《Nucleic Acids Research》在线发表了上海交通大学生命科学技术学院肖华教授课题组的最新研究成果“Massive deciphering of the tissue nucleic acid-binding proteome via affinity chromatography integrated with data-independent acquisition-based proteomics”。该研究将核酸结合蛋白(NABPs)亲和富集技术与数据非依赖采集(DIA)蛋白质组学技术深度融合,建立了全新的NABP-DIA分离分析策略,实现了对低丰度核酸结合蛋白(尤其是转录因子)的高覆盖度、高精确度解析。研究人员采用该技术系统描绘了炎症性肠病小鼠模型中免疫器官的核酸结合蛋白质组变化,发现脾脏在疾病进程中发生了显著的核酸互作重塑,并揭示了EHMT等组蛋白甲基转移酶作为关键表观遗传调控因子在肠炎中的重要功能。进一步的组蛋白翻译后修饰质谱、细胞炎症模型及小鼠结肠炎实验证实了EHMT通过调控H3K27me3等组蛋白甲基化修饰影响炎症反应,为炎症性肠病的表观遗传治疗提供了潜在的新靶点。上海交通大学生命科学技术学院博士毕业生王惠雨、博士研究生朱剑征、李荪涛为该论文的共同第一作者,上海交通大学生命科学技术学院、微生物代谢全国重点实验室肖华教授为该论文的通讯作者。
核酸结合蛋白是维持生命活动的核心调控因子,通过与核酸紧密结合参与 DNA 复制、转录调节、RNA 加工等关键生物学过程,其表达失衡、与核酸互作的改变常与炎症、癌症、衰老等密切相关。然而,由于这类蛋白通常丰度偏低且与核酸的结合呈现动态变化,其在复杂组织样本中的深度解析长期受到现有实验技术的限制。肖华教授团队长期聚焦核酸结合蛋白质组的重要生物学功能研究(Mol. Cell. Proteomics 2023, 22:100611;J. Proteome Res. 2022, 21:220-231;ACS Appl. Mater. Interfaces 2018, 21:17756-17770),在前期工作基础上,针对传统蛋白质组学难以深入捕获低丰度核酸结合蛋白的瓶颈,创新性地将亲和富集策略与DIA 蛋白质组学技术相结合,构建了全新的 NABP-DIA 策略。研究团队以炎症性肠病小鼠模型为研究对象,对其脾脏和胸腺中的核酸结合蛋白质组进行了系统鉴定与功能解析,并进一步结合组蛋白翻译后修饰质谱、细胞与动物模型验证了关键表观遗传调控因子在炎症进程中的功能,其总体研究流程如图1所示。
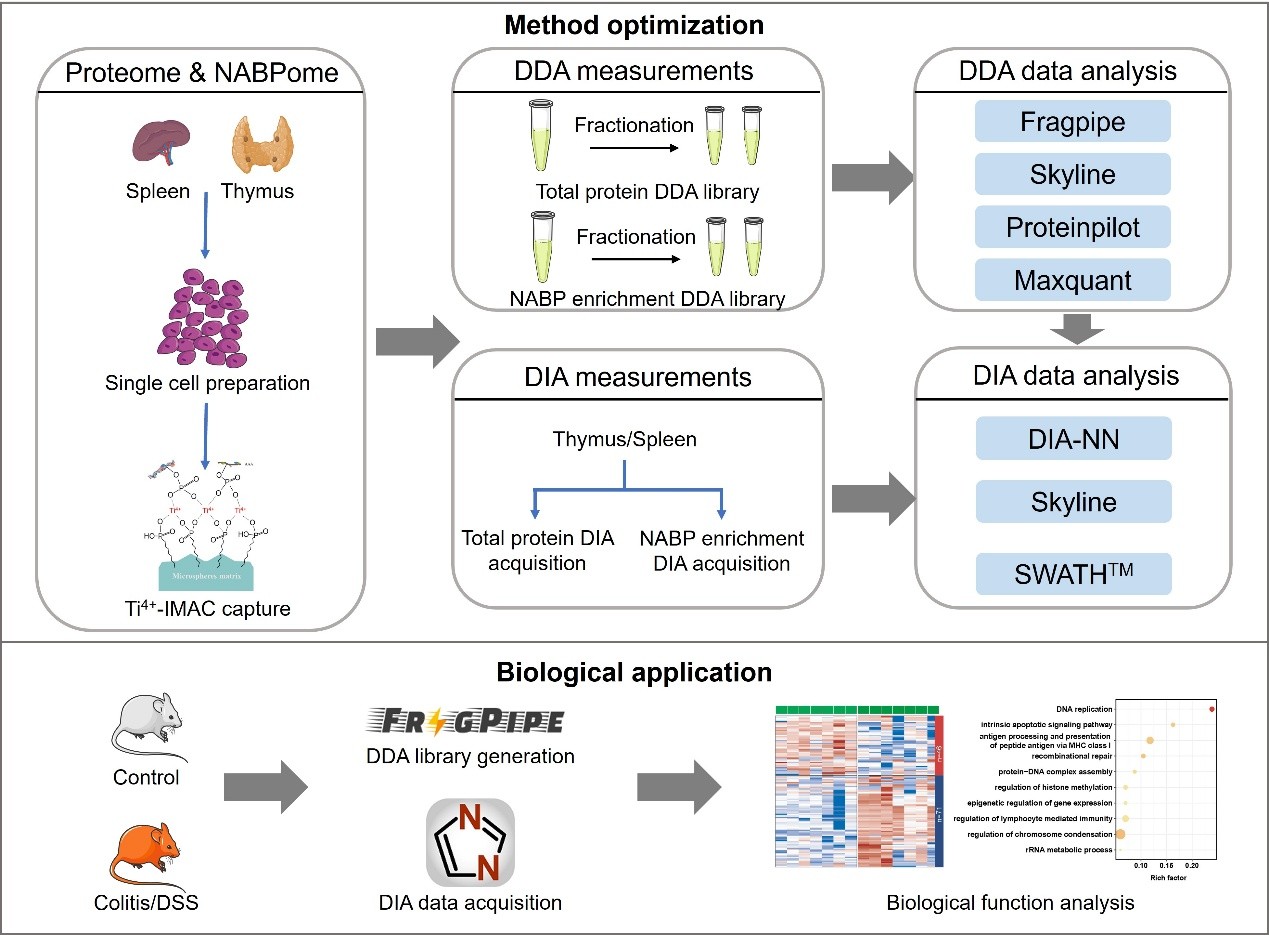
图1. NABP-DIA策略工作流程
研究人员利用固定化钛离子亲和色谱技术结合高分辨率 DIA 蛋白质组学技术,系统绘制了胸腺与脾脏来源核酸结合蛋白的深度图谱。在方法学性能评估阶段,首先比较了不同软件(Fragpipe、Skyline、Proteinpilot、MaxQuant)生成的谱图库质量,其中,Fragpipe鉴定到了最多的蛋白数量(包含6323个蛋白)。接下来,研究人员比较了不同软件(DIA-NN、OpenSWATH、Skyline)处理DIA数据的能力,DIA-NN使用Fragpipe生成的谱图库流程获得了最高的蛋白数量(2984个蛋白),相关结果如图2所示。
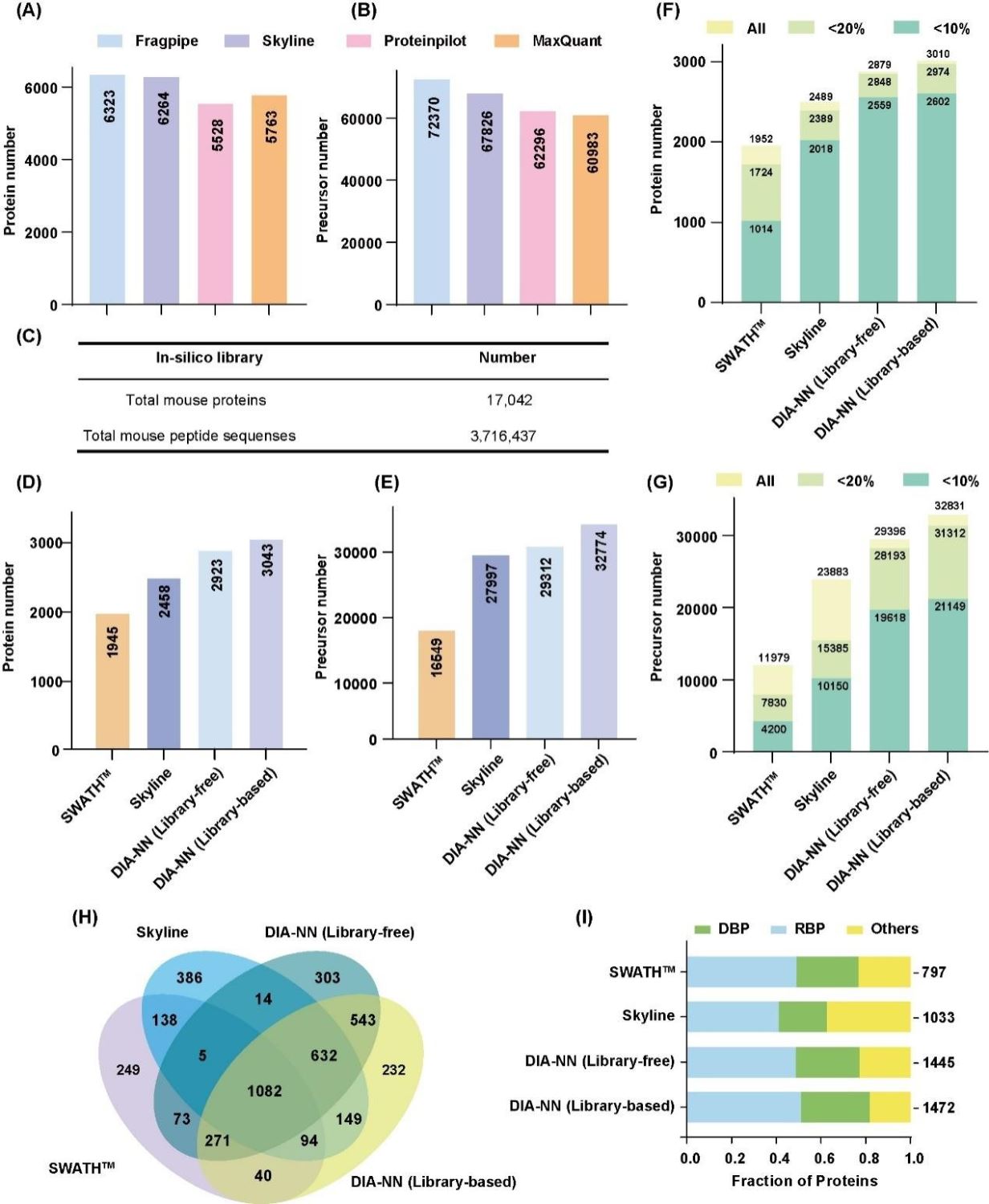
图2. 不同 DIA 分析方法的评估
为了进一步阐明核酸结合蛋白在炎症性肠病中的调控机制,研究团队首先利用硫酸葡聚糖钠盐(DSS)诱导建立了小鼠结肠炎模型,观察到患病小鼠出现明显的体重下降、结肠缩短、脾脏肿大以及广泛的上皮损伤,并伴随CXCL2、IL-1β、IL-6 和 TNF-α 等促炎因子的显著升高。随后结合NABP-DIA技术,对胸腺与脾脏中的核酸结合蛋白质组进行了系统解析,结果显示炎症状态下组蛋白甲基化相关核酸结合蛋白(如EHMT1、EHMT2、EZH2、SUZ12)在脾脏中显著上调,进一步的组蛋白修饰质谱结果证实了H3K27me3、H3K9me3等组蛋白甲基化修饰在结肠炎小鼠中发生了显著变化。功能验证实验表明,EHMT抑制剂能够缓解DSS小鼠的体重下降,同时提高急性模型小鼠的存活率。以上结果表明,脾脏核酸结合蛋白的重塑与异常组蛋白甲基化伴随炎症性肠病的发生,而靶向EHMT可有效缓解炎症,成为潜在的治疗策略,相关结果如图3所示。
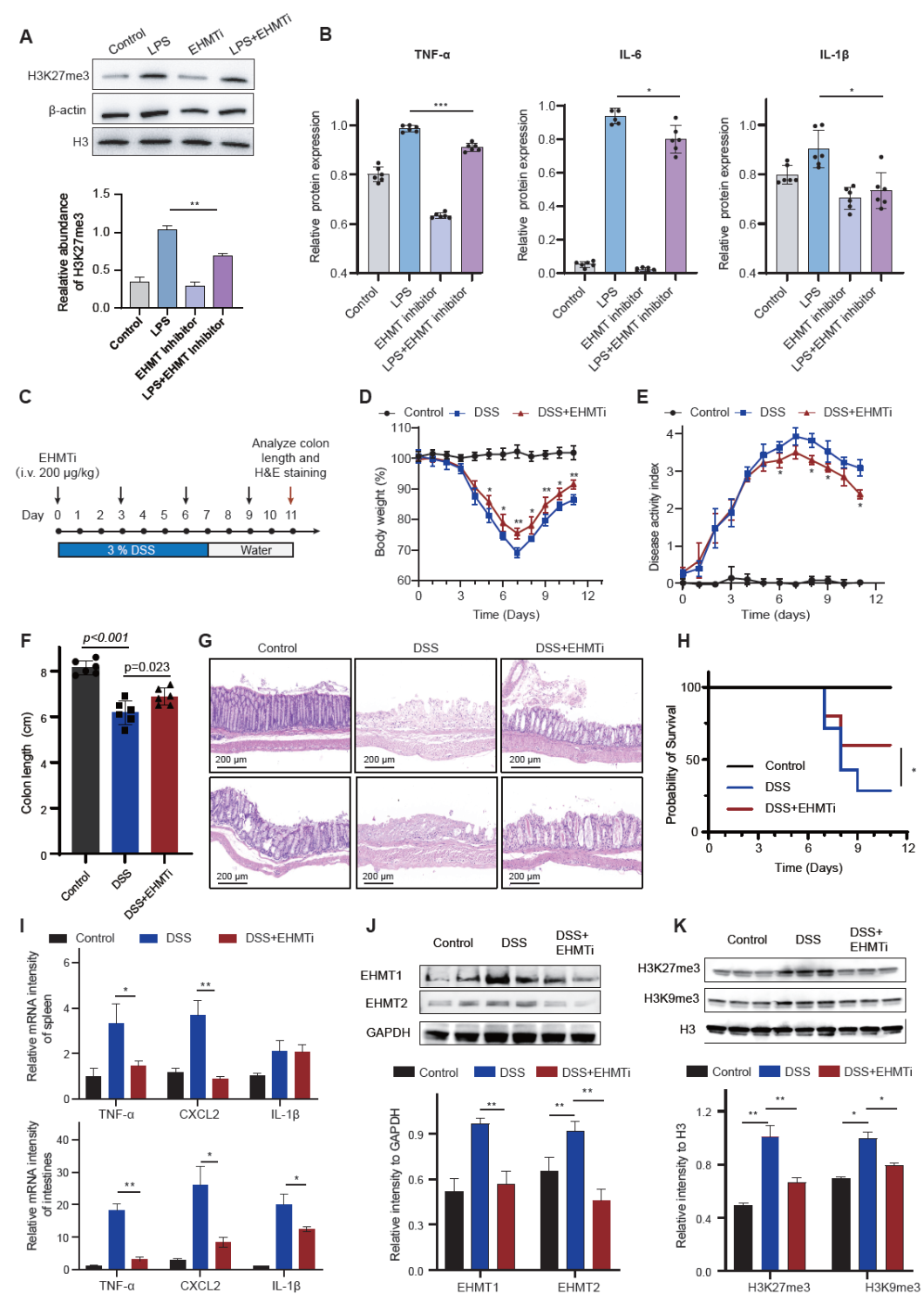
图3. 抑制 EHMT 活性改善 DSS 结肠炎
该研究构建了NABP-DIA分离分析新策略,实现了核酸结合蛋白蛋白组的系统鉴定和功能解析,揭示了肠炎发生过程中脾脏核酸结合蛋白组的动态变化,发现炎症刺激可显著改变免疫细胞的核酸互作网络,引发广泛的转录调控紊乱。该研究不仅揭示了核酸结合蛋白重塑在肠炎免疫激活中的核心机制,更提出EHMT作为潜在的表观治疗靶点,为炎症性肠病及相关免疫疾病的干预提供了新方向。
该研究得到了国家自然科学基金、上海市自然科学基金等项目支持。感谢上海交通大学药学院张岩副教授、上海交通大学自动化与感知学院曹成喜教授、加州大学洛杉矶分校胡深教授对该研究的帮助和支持。
原文链接:https://academic.oup.com/nar/article/53/21/gkaf1167/8328552


 首页
首页

 学院概况
学院概况

 师资队伍
师资队伍

 人才培养
人才培养

 招生就业
招生就业

 科学研究
科学研究

 平台基地
平台基地

 党群工作
党群工作

 校友之家
校友之家

 安全工作
安全工作

 网上办事
网上办事

 当前位置:
当前位置: